奶牛NR1D1基因的真核表达载体构建、表达谱及其在卵巢组织的定位
相关热词搜索:
王逸群,刘祖培,李雅婷,2,张海森,2,李 丹,靳亚平,2,陈华涛,2*
(1.西北农林科技大学动物医学院,杨凌 712100;
2.西北农林科技大学 农业农村部动物生物技术重点实验室,杨凌 712100)
地球的自转带来了光照、温度等外界环境因素的昼夜节律性变化,生物体为预测并适应这些外界环境因素的节律性变化,在漫长的进化过程中逐渐形成了一套内源性的自主调控系统,称为生物钟[1]。生物钟广泛存在于动物、植物、细菌以及真菌等地球上的大部分生命体中,是机体昼夜节律产生的分子基础[2-3]。哺乳动物生物钟是一个完整的层级控制系统,位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN)的中枢生物钟接收并整合视网膜下丘脑束传递的周期性光线信号的明暗变化,通过神经与体液途径将时间信息传递至肝、肺、肌肉、卵巢与睾丸等组织器官,从而协调同步化大量的外周生物钟,共同维持机体生理稳态[4-6]。
在哺乳动物体内,几乎所有的细胞都存在自主维持的昼夜节律振荡器,即由多个生物钟基因及其编码蛋白相互作用构成的转录-翻译反馈环路[7]。核受体NR1D1是昼夜节律生物钟系统的重要组分,由于该蛋白缺乏对配体依赖性共激活因子募集和核受体转录激活至关重要的C端螺旋结构,因此主要表现出转录抑制作用[8-10]。近年来应用基因组学、生化以及药理学技术的众多研究证据表明,NR1D1在昼夜节律以及肝、胰腺、卵巢与睾丸等组织正常生理功能的稳态维持过程中发挥至关重要的作用[11-15]。
目前,对于哺乳动物生物钟系统的研究多以啮齿类动物为模型,关于反刍动物NR1D1基因生物学功能的研究则相对较少。在前期的研究中,人们发现环境因素(光照、温度等)与饲养方式(饲粮配比、限制性饲喂等)的改变能够通过反刍动物的生物钟系统影响其生产性能[16-21]。然而,目前人们对反刍动物生物钟系统分子基础的认识相对有限,深入探究反刍动物生物钟基因的生物学功能,或可为人们寻找提高反刍动物生产性能的新方法和新靶点提供思路。
基于前期研究基础,本试验旨在克隆奶牛NR1D1基因的蛋白编码序列(coding sequence,CDS),构建该基因的真核表达载体,同时使用生物信息学软件对该基因编码蛋白的理化特性进行初步的预测和分析,并利用qPCR及免疫组织化学技术(IHC)检测NR1D1基因在奶牛不同组织的表达谱,以期为深入探究奶牛NR1D1基因的生物学功能提供前期基础和关键材料。
1.1 组织与细胞
5头成年(24月龄)健康雌性奶牛的心、肝、脾、肺、瘤胃、结肠、小肠、胰腺、肌肉及皮下脂肪、卵巢组织采自陕西省咸阳市某屠宰场,DH5α感受态细胞购自北京天根生化科技有限公司,HEK293T细胞由中国科学院典型培养物保藏委员会细胞库提供。
1.2 主要试剂
Trizol、PrimeSTAR Max DNA Polymerase、QuickCutBamH Ⅰ均购自日本TaKaRa公司,FSQ-301反转录试剂盒购自日本TOYOBO公司,DNase/RNase-Free Water购自北京索莱宝科技有限公司,ClonExpress II One Step Cloning Kit、SYBR qPCR Master Mix均购自南京诺唯赞生物科技有限公司,无内毒素质粒小提中量试剂盒购自北京天根生化科技有限公司,Turbofect转染试剂购自美国Thermo Fisher公司,Anti-HA tag Antibody、Anti-NR1D1 Antibody均购自美国Abcam公司,多聚甲醛固定液购自武汉赛维尔生物科技有限公司,免疫组化超敏UltraSensitiveTMSP试剂盒购自福州迈新生物技术开发有限公司。
1.3 引物设计与合成
根据NCBI数据库中的基因序列信息,在线设计可扩增奶牛NR1D1基因CDS区全长的PCR引物、可同时扩增奶牛与人NR1D1基因的实时荧光定量PCR(qPCR)引物;
并设计扩增人、奶牛GAPDH基因与奶牛RPLP0基因的qPCR内参引物,引物序列信息见表1(小写字母表示同源臂,下划线部分表示BamH Ⅰ的酶切位点)。引物均由西安擎科生物科技有限公司合成。

表1 引物信息Table 1 Primer sequences information
1.4 奶牛NR1D1基因真核表达载体构建及鉴定
1.4.1 PCR扩增奶牛NR1D1基因的CDS区 使用Trizol法提取奶牛肝组织的总RNA,按照逆转录试剂盒说明书合成cDNA。以cDNA为模板,使用带有同源臂的引物进行PCR反应,反应体系50 μL:2×PrimeSTAR Max Premix 25 μL,cDNA模板(50 ng·μL-1)4 μL,上、下游引物(10 μmol·L-1)各1 μL,ddH2O 19 μL。反应程序:98 ℃预变性30 s;
98 ℃变性10 s,63 ℃退火15 s,72 ℃延伸56 s,共35个循环;
72 ℃终延伸2 min。
1.4.2 同源重组法构建奶牛NR1D1基因真核表达载体 使用限制性内切酶BamH Ⅰ对pcDNA3.1-Puro-N-3HA载体进行单酶切使其线性化,按照ClonExpress Ⅱ试剂盒说明书配制同源重组反应体系,37 ℃反应30 min后立即置于冰上冷却。重组产物转化大肠杆菌DH5α感受态细胞,将菌液涂布至含羧苄青霉素的LB固体培养基37 ℃过夜培养后,挑取单克隆菌落接种至含有羧苄青霉素的LB液体培养基,37 ℃ 200 r·min-1摇床培养12 h后,使用无内毒素质粒小提中量试剂盒提取质粒。
1.4.3NR1D1基因真核表达载体的鉴定 使用限制性内切酶BamH Ⅰ对获得的重组质粒进行单酶切,同时使用空载体作为对照;
以重组质粒为模板,使用NR1D1基因CDS区扩增引物进行PCR反应。酶切及PCR产物经琼脂糖凝胶电泳鉴定,将结果符合预期的样本送至西安擎科生物科技有限公司测序,比较插入片段序列与NCBI数据库中奶牛NR1D1基因序列是否一致。
1.5 奶牛NR1D1基因序列及其编码蛋白的生物信息学分析
在NCBI中查找不同物种NR1D1基因序列(表2),结合测序结果,利用MegAlign软件分析各物种间NR1D1基因CDS区的同源性,并利用MEGA7软件构建系统进化树;
利用在线软件分析预测奶牛NR1D1蛋白性质及生物学功能,在线软件及网址见表3。
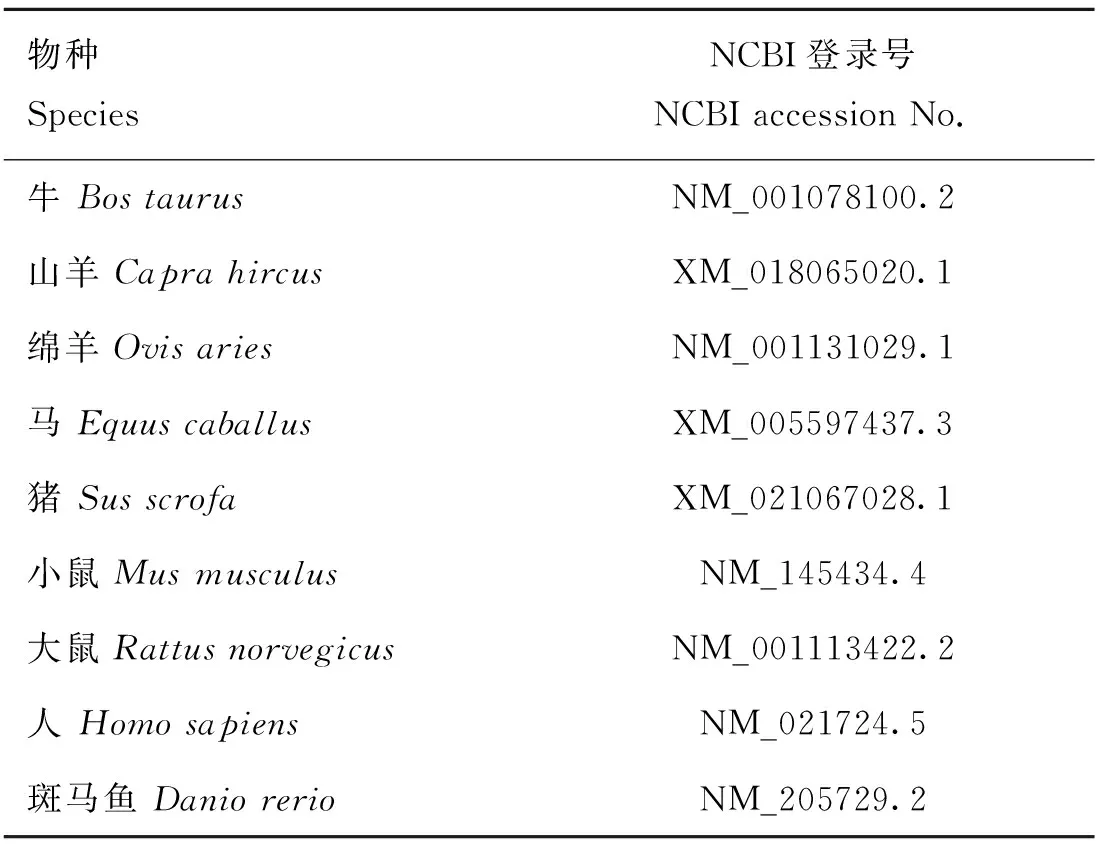
表2 各物种NR1D1基因CDS序列来源Table 2 The sources of NR1D1 gene’s CDS in each species

表3 所用生物信息学在线软件Table 3 Bioinformatics online softwares
1.6 检测奶牛NR1D1基因在HEK293T细胞的过表达
1.6.1 细胞培养与转染 复苏HEK293T细胞并传代,待细胞长满60 mm培养皿后,将其消化传代至两个6孔板中继续培养,细胞密度达到60%以上时,每个6孔板分别转染pcDNA3.1-3HA-cNR1D1重组质粒(过表达组)及pcDNA3.1-Puro-N-3HA空质粒(对照组)各3孔,培养24 h后,收取一个6孔板中的细胞样品,用于检测NR1D1基因在mRNA水平的过表达效果;
培养48 h后,收取另一6孔板中的细胞样品,用于检测NR1D1蛋白的过表达效果。
1.6.2 实时荧光定量PCR检测奶牛NR1D1基因在mRNA水平的表达 提取对照组和过表达组细胞的总RNA,反转录合成cDNA作为qPCR反应的模板。20 μL反应体系:2×ChemQ SYBR qPCR Master Mix 10 μL,cDNA模板(2.5 ng·μL-1)5 μL,上、下游引物各0.4 μL(10 μmol·L-1),ddH2O 4.2 μL。反应程序:95 ℃预变性3 min;
95 ℃变性10 s,60 ℃退火与延伸30 s,40个循环;
熔解曲线95 ℃ 10 s;
65 ℃ 60 s,后以每秒0.2 ℃升温至97 ℃,采集熔解曲线荧光信号。
1.6.3 Western blotting检测奶牛NR1D1蛋白的表达水平 提取对照组和过表达组细胞的总蛋白,进行SDS-PAGE凝胶电泳,上样量为15 μg;
将35~100 ku区域的蛋白转印至硝酸纤维素(PVDF)膜,10%脱脂奶粉室温封闭2 h后洗膜(TBST溶液洗膜3次,每次10 min,下同);
根据目的蛋白大小将PVDF膜剪开,分别置于一抗(兔抗HA多克隆抗体、兔抗NR1D1单克隆抗体、兔抗β-Actin单克隆抗体)中,4 ℃孵育过夜,洗膜;
将PVDF膜转移至二抗(HRP共扼羊抗兔抗体),室温孵育1 h,洗膜;
将PVDF膜置于暗室,均匀滴加适量ECL发光液,进行曝光。
1.7 qPCR检测NR1D1基因在奶牛不同组织的表达谱
分别称取20 mg奶牛的不同组织,加入1 mL Trizol,使用组织匀浆器将其研磨至匀浆,Trizol法提取总RNA,反转录合成cDNA作为模板,以奶牛GAPDH、RPLP0基因为内参,qPCR检测奶牛NR1D1基因在不同组织的表达情况。qPCR反应体系与反应程序同“1.6.2”。
1.8 IHC检测NR1D1蛋白在奶牛卵巢组织的分布
将固定后的奶牛卵巢组织修整为2 cm×0.5 cm×2 cm左右的小块,注意保持较大黄体及卵泡结构的完整性。将修整后的组织块置于梯度乙醇溶液中脱水,脱水后置于二甲苯中透明,随后将组织浸蜡、包埋,制作石蜡切片。取奶牛卵巢组织石蜡切片,使用二甲苯将石蜡切片充分脱蜡,依次经梯度乙醇水化后,将石蜡切片放入柠檬酸抗原修复液中,使用微波炉高火加热至沸腾后,中火继续加热20 min,进行抗原修复,待完全冷却至室温后,PBS清洗(每次5 min,共计4次),用油笔在组织周围3 mm处画圈。按照免疫组化超敏UltraSensitiveTMSP试剂盒说明书对抗原修复后的切片进行免疫组织化学染色,使用光学显微镜观察NR1D1在卵巢不同发育阶段卵泡中的表达分布情况并拍照保存[22]。
1.9 数据统计分析
采用2-ΔΔCt法将qPCR中的Ct值转化为基因相对表达量,利用GraphPad Prism 6分析定量数据。进行非配对t检验,比较对照组与过表达组HEK293T细胞中NR1D1 mRNA表达水平的差异性;
进行单因素方差分析,以比较奶牛不同组织中NR1D1 mRNA表达水平的差异性。P< 0.05表示差异显著,P< 0.01表示差异极显著,结果以“平均值±标准误”表示。
2.1 奶牛NR1D1基因CDS区全长序列的获取
对PCR扩增产物进行琼脂糖凝胶电泳,结果如图1所示,奶牛NR1D1基因CDS区PCR扩增产物在接近2 000 bp处有一清晰、明亮的条带,且条带大小与预期一致(奶牛NR1D1基因CDS区全长序列1 842 bp,同源臂42 bp),说明成功获得奶牛NR1D1基因CDS区全长片段。
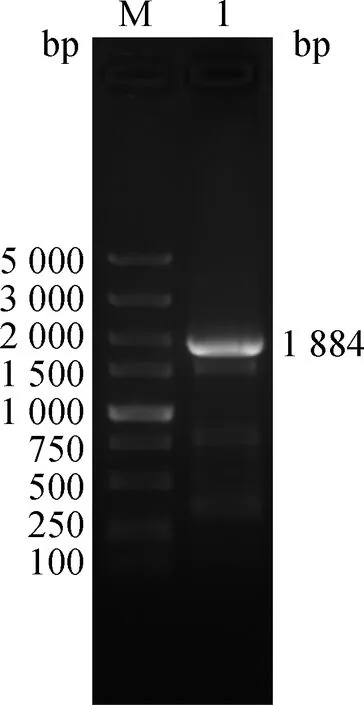
M. 5 000 bp DNA相对分子质量标准;
1.NR1D1基因CDS区全长的PCR扩增产物M. 5 000 bp DNA marker; 1. PCR amplification product of NR1D1 gene’s full-length CDS region图1 奶牛NR1D1基因CDS区全长PCR扩增产物的鉴定结果Fig.1 Identification results of the PCR amplification products of the cow NR1D1 gene’s full-length CDS region
2.2 奶牛NR1D1基因真核表达载体的构建
重组质粒单酶切及PCR鉴定产物琼脂糖凝胶电泳结果如图2所示,重组质粒单酶切后,分别在预期的位置出现2个条带(5 211 bp和1 842 bp),条带大小与空质粒单酶切条带及重组质粒PCR扩增产物条带大小一致。测序结果显示,重组质粒中插入片段序列与NCBI数据库中牛NR1D1基因CDS区序列完全一致,表明pcDNA3.1-3HA-cNR1D1重组质粒构建成功。
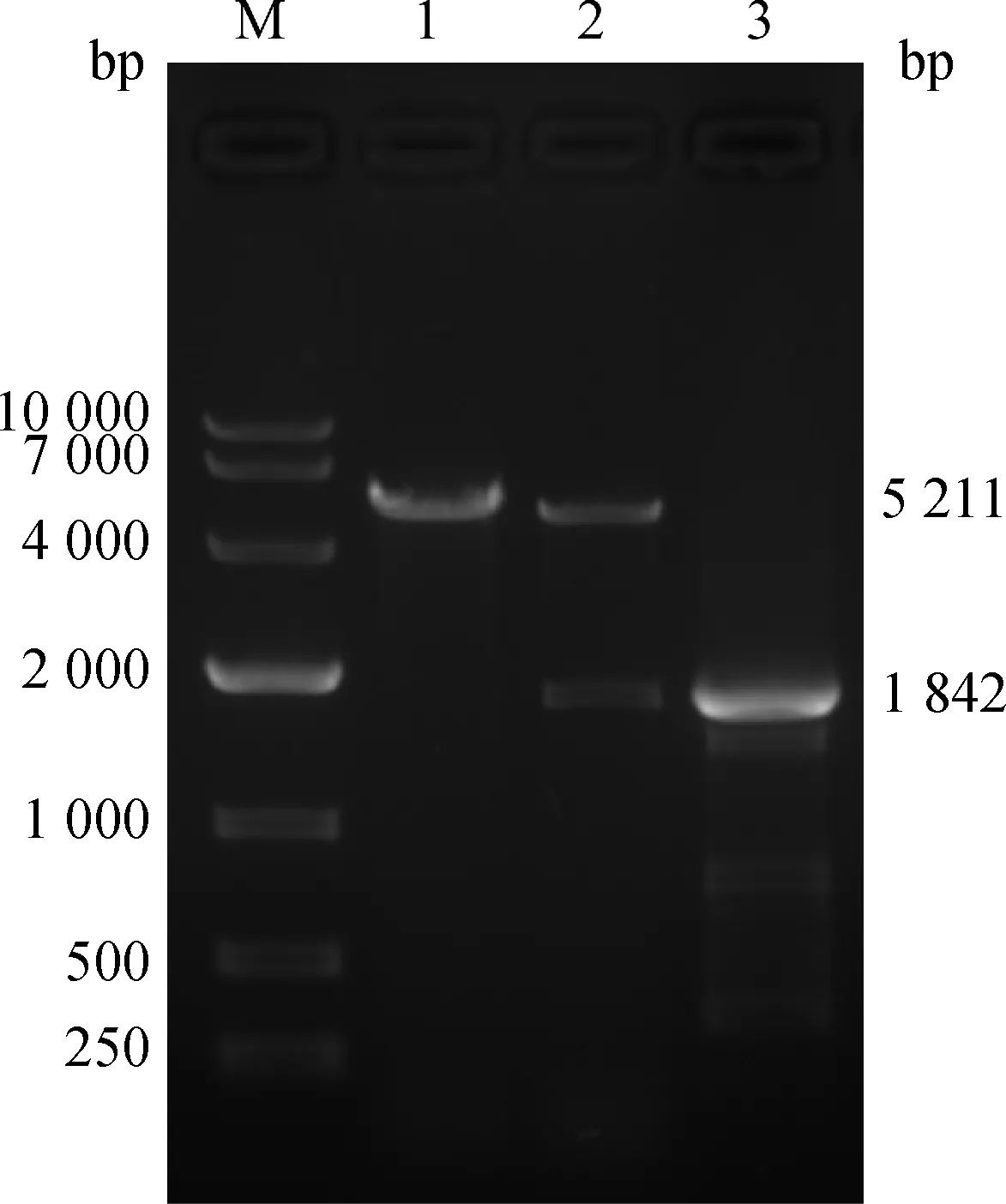
M. 10 000 bp DNA相对分子质量标准;
1.空质粒单酶切产物;
2.重组质粒单酶切产物;
3.重组质粒PCR扩增产物M. 10 000 bp DNA marker; 1. Single digestion product of empty plasmid; 2. Single digestion product of recombinant plasmid; 3. PCR amplification product of recombinant plasmid图2 奶牛NR1D1基因真核表达载体酶切及PCR鉴定Fig.2 Enzyme digestion and PCR identification of cow NR1D1 gene’s eukaryotic expression vector
2.3 奶牛NR1D1基因CDS区序列分析
对不同物种NR1D1基因CDS区进行同源性比对,结果如图3所示,NR1D1基因CDS区在反刍动物间高度保守,同源性在97%以上,且牛NR1D1基因CDS区与猪、马、大鼠、小鼠、人的同源性超过85%,说明哺乳动物NR1D1基因CDS区总体较为保守。根据同源性比对结果构建系统进化树,结果如图4所示,牛NR1D1基因CDS区与山羊、绵羊遗传距离最近,与斑马鱼的遗传距离最远。

图3 不同物种NR1D1基因CDS区同源性比对Fig.3 Homology comparison of NR1D1 gene’s CDS region in different species

图4 奶牛NR1D1基因CDS区系统进化树Fig.4 Phylogenetic tree of the cow NR1D1 gene’s CDS region
2.4 奶牛NR1D1蛋白理化性质与功能预测分析
2.4.1 奶牛NR1D1蛋白的基本理化性质 利用ProtParam预测奶牛NR1D1蛋白的基本理化性质,结果显示,NR1D1蛋白共包含613个氨基酸,分子量为67 ku,理论等电点为8.75。利用ProtScale预测NR1D1蛋白亲水性,结果如图5所示,NR1D1蛋白第212位氨基酸分值最低(-2.822),表明该位点亲水性最强;
第541位氨基酸分值最高(2.633),表明该位点疏水性最强。且NR1D1蛋白总平均亲水性(GRAVY)为-0.494,多数氨基酸表现出亲水性,说明奶牛NR1D1蛋白为亲水性蛋白。
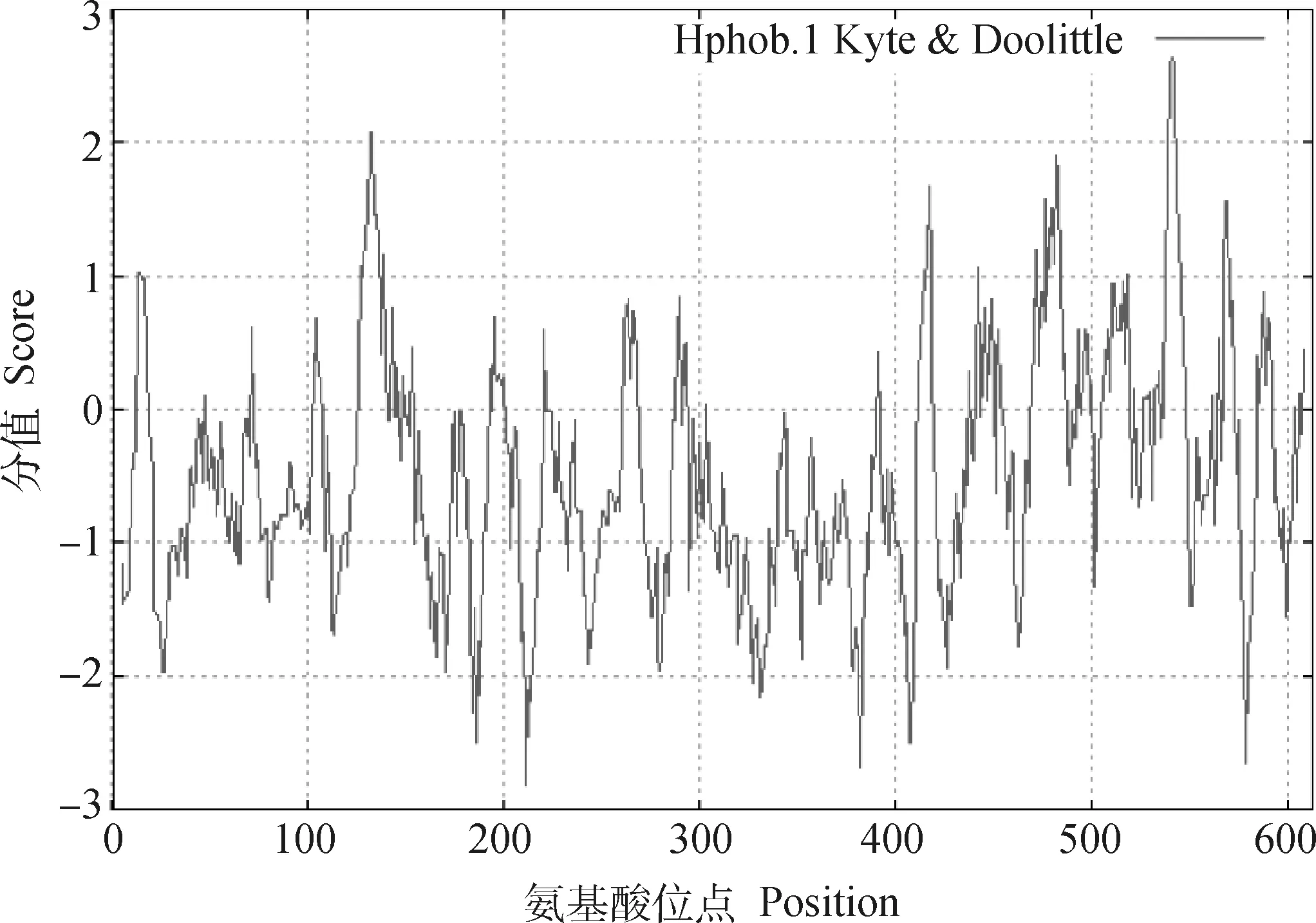
图5 奶牛NR1D1蛋白亲水性预测Fig.5 Hydrophilic prediction of cow NR1D1 protein
2.4.2 奶牛NR1D1蛋白跨膜结构及亚细胞定位分析 应用DeepTMHMM对奶牛NR1D1蛋白跨膜结构进行预测,结果如图6A所示,奶牛NR1D1蛋白为胞内蛋白,不含跨膜区。应用DeepLoc-1.0预测奶牛NR1D1蛋白的亚细胞定位,结果如图6B显示,奶牛NR1D1蛋白定位于细胞核中,其核定位序列位于第200位氨基酸附近。
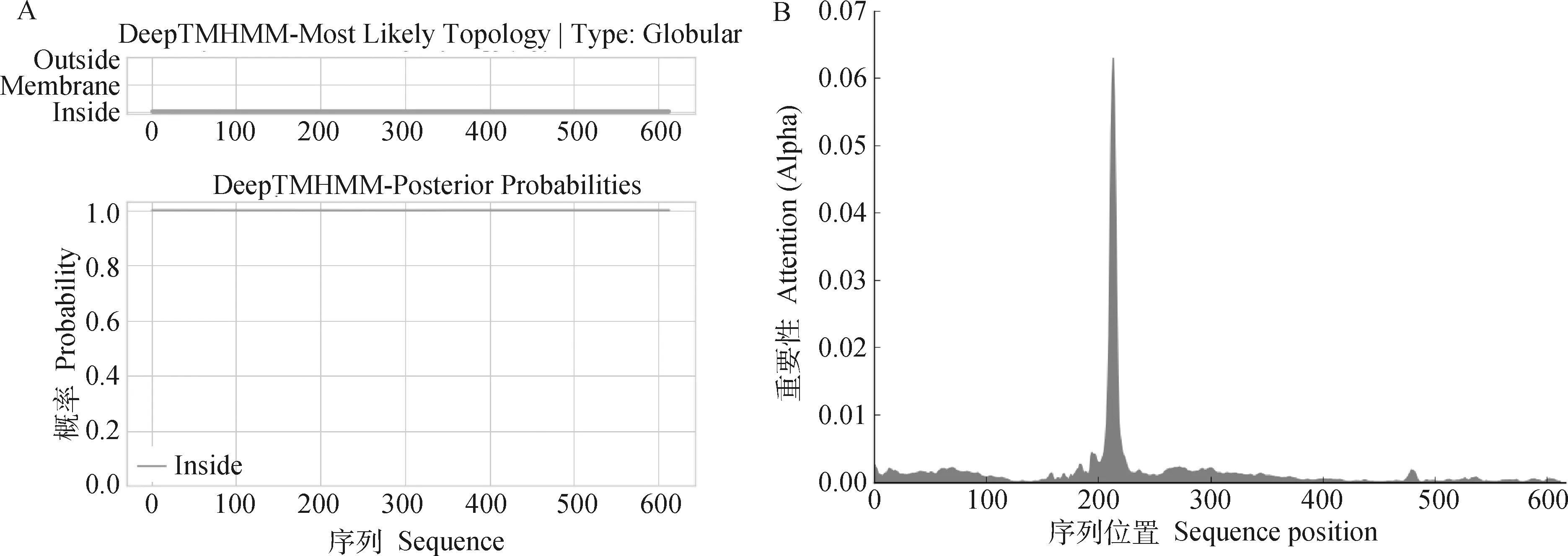
A. NR1D1蛋白跨膜结构预测;
B. NR1D1蛋白核定位序列预测A. Prediction of NR1D1’s transmembrane structure; B. Prediction of NR1D1’s nuclear localization sequence图6 奶牛NR1D1蛋白跨膜结构及核定位序列分析Fig.6 Transmembrane structure and nuclear localization sequence analysis of cow NR1D1
2.4.3 奶牛NR1D1蛋白磷酸化位点预测 应用NetPhos-3.1软件预测奶牛NR1D1蛋白磷酸化位点,结果如图7所示,奶牛NR1D1蛋白共存在86个潜在的磷酸化位点,其中包含63个丝氨酸位点、18个苏氨酸位点以及5个酪氨酸位点。
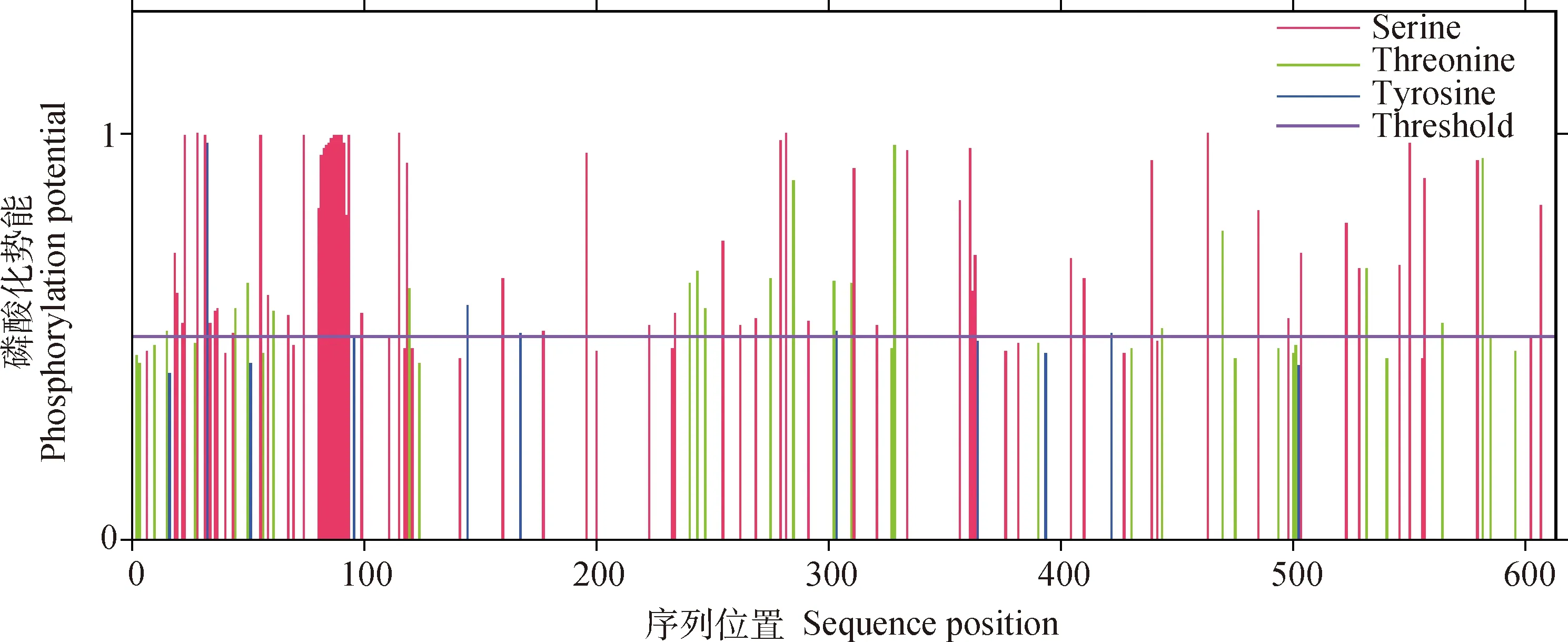
图中红色表示丝氨酸位点;
绿色表示苏氨酸位点;
蓝色表示酪氨酸位点;
紫色表示阈值In this figure, red stands for serine; green stands for threonine; blue stands for tyrosine; purple stands for threshold图7 奶牛NR1D1蛋白磷酸化位点预测Fig.7 Prediction of phosphorylation sites of cow NR1D1 protein
2.4.4 奶牛NR1D1蛋白结构预测 利用SOPMA预测奶牛NR1D1蛋白的二级结构,结果如图8A所示,奶牛NR1D1蛋白二级结构主要由无规则卷曲、α-螺旋、延伸链、β-转角组成,占比依次为55.30%、25.77%、13.05%和5.87%。利用SWISS-MODEL对奶牛NR1D1蛋白三级结构进行预测,并用PyMOL软件比较奶牛、山羊、小鼠NR1D1蛋白三级结构的相似性,结果如图8B所示,奶牛与山羊NR1D1蛋白间的原子均方根差(RMSD)为1.576,奶牛与小鼠NR1D1蛋白间RMSD为1.933,说明奶牛NR1D1蛋白三级结构与山羊、小鼠较为相似。

A. 奶牛NR1D1蛋白二级结构预测,图中蓝色表示α-螺旋,红色表示延伸链,绿色表示β-转角,紫色表示无规则卷曲;
B. 奶牛(a)、山羊(b)、小鼠(c)NR1D1蛋白三级结构预测,图中蓝色表示α-螺旋,红色表示β-折叠,紫色表示无规则卷曲A. Prediction of the secondary structure of cow NR1D1 protein, blue represents α-helix, red represents extended strand, green represents β-turn, and purple represents random coil; B. Predicted tertiary structure of NR1D1 protein in cow (a), goat (b) and mouse (c), blue represents α-helix, red represents β-sheet, and purple represents random coil图8 奶牛NR1D1蛋白三级结构预测及比较Fig.8 Prediction and comparison of the tertiary structure of cow NR1D1 protein
2.4.5 奶牛NR1D1蛋白互作与功能分析 使用STRING对奶牛NR1D1蛋白互作进行预测分析,结果如图9所示,与NR1D1发生互作的前10位蛋白包括芳香烃受体核转位因子样蛋白(aryl hydrocarbon receptor nuclear translocator-like protein 1,ARNTL)、时钟昼夜节律调节蛋白(circadian locomotor output cycles kaput protein,CLOCK)、隐花色素昼夜节律调节蛋白2(cryptochrome circadian clock 2,CRY2)、神经元PAS结构域蛋白2(neuronal PAS domain protein 2,NPAS2)、基本螺旋-环-螺旋家族成员e41(basic helix-loop-helix family member e41,BHLHE41)、热休克转录因子2(heat shock transcription factor 2,HSF2)、磷脂酶C-β2(phospholipase C-β2,PLCB2)、核受体辅抑制因子1(nuclear receptor co-repressor 1,NCOR1)、含金属β内酰胺酶结构域蛋白1(metallo-β-lactamase domain-containing protein 1,MBLAC1)与RAS激活剂样蛋白3(RAS protein activator-like 3,RASAL3)。功能预测分析结果显示,NR1D1能够直接抑制核心生物钟组分ARNTL(BMAL1)、CLOCK和CRY2的表达,负反馈调节昼夜节律生物钟系统;
此外,其还与脂质和胆汁酸代谢、脂肪生成、糖异生和巨噬细胞炎症反应等生理过程密切相关;
在细胞层面,NR1D1可能参与氧化还原状态应答、类固醇激素受体及糖皮质激素受体信号通路的负反馈调节等过程。
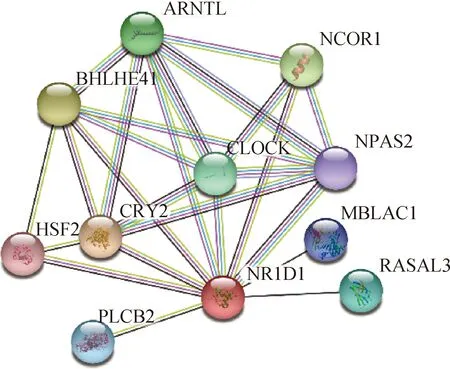
图9 奶牛NR1D1蛋白互作预测Fig.9 Prediction of cow NR1D1 protein’s interaction
2.5 奶牛NR1D1基因在HEK293T细胞中的过表达
重组质粒转染HEK293T细胞后,奶牛NR1D1基因在mRNA和蛋白水平的过表达效果如图10所示,与对照组相比,重组质粒转染组奶牛NR1D1 mRNA表达水平升高约2 000倍(P< 0.01);
应用HA及NR1D1抗体进行Western blotting检测,结果显示重组质粒转染组的奶牛NR1D1蛋白相对于对照组有显著的过表达。

A. pcDNA3.1-3HA-cNR1D1转染后mRNA相对表达量,**P<0.01表示差异极显著;
B. pcDNA3.1-3HA-cNR1D1转染后NR1D1蛋白的表达,M表示蛋白分子量标准;
CON. 空质粒转染对照组;
OVE. 重组质粒转染组A. Relative mRNA expression after transfecting pcDNA3.1-3HA-cNR1D1, **P<0.01 indicates a very significant difference; B. Expression level of NR1D1 protein after transfecting pcDNA3.1-3HA-cNR1D1, M denotes protein molecular weight standard; CON. Control group transfected empty plasmid; OVE. Test group transfected recombinant plasmid图10 奶牛NR1D1基因在HEK293T细胞的过表达Fig.10 Overexpression of cow NR1D1 gene in HEK293T cells
2.6 NR1D1基因在奶牛不同组织的表达谱
如图11所示,NR1D1基因在奶牛不同组织中的mRNA表达丰度存在显著性差异(P<0.05),奶牛NR1D1基因在瘤胃、结肠与肝中表达量较高,在小肠、胰腺、皮下脂肪与肌肉中表达量较低。

图中不同字母表示差异显著(P<0.05)In each set of bars, different letters mean significant difference (P<0.05)图11 奶牛NR1D1基因mRNA在不同组织的表达丰度Fig.11 Expression abundance of cow NR1D1 gene’s mRNA in different tissues
2.7 NR1D1蛋白在奶牛卵巢组织的表达分布
如图12所示,NR1D1表达于不同发育时期卵泡的颗粒细胞中,且该蛋白主要表达分布于细胞核内。

A.初级卵泡(400×,NR1D1抗体);
B.次级卵泡(200×,NR1D1抗体);
C.卵丘-卵母细胞(200×,NR1D1抗体);
D.颗粒细胞(200×,NR1D1抗体);
E.卵丘-卵母细胞(200×,阴性对照);
F.颗粒细胞(200×,阴性对照)A. Primary follicle (400×, Anti-NR1D1); B. Secondary follicle (200×, Anti-NR1D1); C. Cumulus-oocyte (200×, Anti-NR1D1); D. Granulosa cells (200×, Anti-NR1D1); E. Cumulus-oocyte (200×, negative control); F. Granulosa cells (200×, negative control)图12 NR1D1在奶牛卵巢组织的表达分布Fig.12 The distribution of NR1D1 in dairy cow’s ovary
近年来在啮齿类动物中的研究发现,NR1D1不仅是哺乳动物生物钟系统的重要组分,同时也参与调控生殖、代谢与免疫等多个重要生理过程,但奶牛NR1D1基因的功能还未被深入研究。本课题组前期已成功构建了多个山羊生物钟基因的真核表达载体,并以此为材料探究了生物钟基因BMAL1对山羊睾丸间质细胞睾酮合成的调控作用[23-25]。BMAL1基因在山羊睾丸间质细胞过表达后,上调类固醇激素合成关键基因StAR和HSD17B3在mRNA及蛋白水平的表达,睾酮合成增加。此外,本课题组利用pcDNA3.1-gRORα载体在HEK293T细胞中进行了双荧光素酶报告试验,检测到山羊RORα蛋白显著上调了山羊BMAL1和NR1D1基因启动子的转录活性,探究了该蛋白的生物学功能[26-27]。上述证据说明,以pcDNA3.1为骨架构建的真核表达载体是一个可靠的载体工具,可帮助研究者们深入探究反刍动物生物钟系统相关基因在生殖与代谢等生理过程中的功能与作用机制。
NR1D1作为一种重要的核受体,主要通过结合靶基因启动子区域的顺式作用元件RORE抑制其转录,是哺乳动物生物钟补充反馈环路中重要的负调控因子,同时也参与调控糖脂代谢、炎症与免疫、繁殖等过程中关键基因的表达[8, 13, 28-30]。本研究利用多种生物信息学软件预测分析了奶牛NR1D1基因及其编码蛋白的理化性质和生物学特性,结果显示NR1D1基因在哺乳动物间同源性较高,说明该基因在进化过程中相对保守;
而牛、山羊及小鼠NR1D1蛋白的三级结构较为相似,提示NR1D1蛋白功能可能在反刍动物与小鼠之间存在相似之处。因此,有关小鼠NR1D1基因的研究结果或可为探究奶牛NR1D1基因功能提供一定的参考。
蛋白质相互作用预测结果表明,与NR1D1发生互作的前10位蛋白中,除ARNTL(BMAL1)、CLOCK、CRY2等昼夜节律生物钟蛋白外,还包括转录抑制因子NCOR1,以及PLCB2、RASAL3等一些参与细胞信号转导且与免疫过程相关的调控因子[31-32]。其中,HSF2在哺乳动物精子发生中发挥重要作用,其缺失导致睾丸体积缩小、精子数目减少并损害雄性动物生殖能力[33];
此外,一项近期的研究发现,HSF2能够缓解肠道炎症,在结肠炎中发挥保护作用[34]。以上结果表明,NR1D1可能在奶牛生物钟系统以及免疫、糖脂代谢与生殖等众多生理过程中发挥特定的作用,但这些仅为初步预测分析结果,尚需进一步的验证。
因此,在功能预测分析的基础上,本研究利用qPCR技术检测了NR1D1基因在奶牛不同组织的表达分布。此前,Dai等[35]检测到生物钟基因NR1D1在雄性天祝白牦牛下丘脑-垂体-性腺轴(HPG轴)的不同组织中均有表达分布,且IHC结果显示,NR1D1主要表达于牦牛睾丸组织各种生精细胞以及合成类固醇激素的睾丸间质细胞中。上述研究重点关注的是NR1D1在雄性牦牛生殖过程中的功能,而本研究检测到NR1D1基因在奶牛多个组织中均有表达,其mRNA在瘤胃中的表达丰度极显著高于其他组织,其次是结肠与肝,推测该基因可能参与奶牛体内营养物质的消化吸收以及能量代谢等过程。瘤胃是反刍动物特有的消化器官之一,也是其营养物质消化分解的主要部位[36]。Gao等[37]通过体外试验研究发现,山羊瘤胃上皮细胞增殖和短链脂肪酸转运蛋白的mRNA丰度与生物钟蛋白PER2有关,提示生物钟可能参与瘤胃中某些生物学过程的调控。那么,作为生物钟系统重要组分的NR1D1在其中发挥了何种功能,值得进一步探究。
卵巢颗粒细胞主要分泌雌二醇(E2),是参与哺乳动物类固醇激素合成与分泌的重要细胞类群,它能够为卵母细胞提供营养物质和能量,对卵母细胞的发育、成熟以及正常功能的维持具有重要意义[38]。已有证据表明,NR1D1在大鼠卵巢中能够调节类固醇激素合成和雌性生殖能力[39-40]。本研究采用IHC染色的方法,检测发现NR1D1主要分布在卵巢颗粒细胞中。类似地,Wang等[41]通过IHC及免疫荧光染色发现,NR1D1在猪卵巢颗粒细胞中高表达,且主要分布在细胞核中,进一步研究发现,体外培养的猪卵巢颗粒细胞中NR1D1与类固醇合成关键基因CYP19A1、CYP11A1和StAR的表达呈现节律性。因此,推测在奶牛卵巢中,NR1D1基因可能同样参与调控类固醇激素合成、卵泡发育等过程,但其具体作用以及调控机制还需进一步的试验验证。
本研究成功构建了奶牛NR1D1基因真核表达载体,并实现了奶牛NR1D1基因在HEK293T细胞的高效表达。对奶牛NR1D1基因及其编码蛋白进行了生物信息学分析,并获得了该基因的组织表达谱,该基因在奶牛多个组织中均有分布,但表达水平存在显著差异,在瘤胃、结肠与肝中的表达量显著高于其他组织。在奶牛卵巢组织中,NR1D1的表达具有细胞类型的特异性,主要分布在不同发育阶段卵泡的颗粒细胞中。本研究结果为深入探究奶牛NR1D1基因的生物学功能提供了前期基础与关键材料。
猜你喜欢 生物钟质粒奶牛 周末“补觉”是一个谎言疯狂英语·新读写(2022年6期)2022-11-22乍暖还寒时奶牛注意防冻伤今日农业(2022年3期)2022-11-16夏季奶牛如何预防热应激今日农业(2021年10期)2021-07-28mcr-1阳性类噬菌体质粒与F33∶A-∶B-质粒共整合形成的融合质粒的生物学特性分析江西农业学报(2021年4期)2021-04-20奶牛吃草小天使·一年级语数英综合(2019年12期)2019-01-13打乱生物钟会让人变丑奥秘(2018年1期)2018-07-02智能生物钟语文世界(小学版)(2018年2期)2018-03-08神通广大的生物钟小学阅读指南·低年级版(2017年4期)2017-04-24重组质粒rAd-EGF构建并转染hDPSCs对其增殖的影响西南医科大学学报(2015年1期)2015-08-22Survivin-siRNA重组质粒对人神经母细胞瘤细胞SH-SY5Y的作用中国当代医药(2015年9期)2015-03-01- 创业指南
- 网上开店
- 养殖视频
- 理财
- 政策
- 技术
- 致富视频
-
2018重磅网红极品尤物私人玩物 重磅发布!2018年新经济之王年度人物
这并非容易的一年,也并非确定的一年。2018,在后浪接前浪的创业潮屹立,或许比之前任何一年都更不容易。这是真正gobigorgohome的时刻,在此中顽强生存中者,值得我们前...
【创业人物】 日期:2018-11-29
-
2018重磅网红极品尤物私人玩物 [重磅发布!2018年新经济之王年度人物]
这并非容易的一年,也并非确定的一年。2018,在后浪接前浪的创业潮屹立,或许比之前任何一年都更不容易。这是真正gobigorgohome的时刻,在此中顽强生存中者,值得我们前...
【官司案例】 日期:2018-11-30
-
2018重磅网红极品尤物私人玩物【2018 CBME AWARDS中国孕婴童产业大奖重磅揭晓,qtools受邀为获奖...】
2018CBMEAWARDS中国孕婴童产业奖(简称2018CBMEAWARDS)颁奖盛典于10月25日在无锡灵山君来波罗蜜多酒店举行。逾四百位孕婴童业界领袖聚首,参与一年一度的孕婴童人盛会,...
【咖啡店】 日期:2018-11-29
-
[饲养by蛇君微盘]饲养蛇君全文阅读微盘
蛇君txt下载地址私你好,小说魔妃嫁到:这个是qqhttp:
【餐饮店】 日期:2018-12-02
-
【欧致富怎么才是少将】欧致富为什么是少将
中华人民共李敬茹中华人民共中国人民解少将:191955年丁钊丁盛于中国人民解一个大将张一个大将张一个大将张还有一个军吴克华莫文一个大将张1955年1,中国人一、10名10名...
【致富经创业故事】 日期:2018-11-30
-
养鸽场对联_结婚对联大全2018
鸽呈祥靓明深圳市文楷专长放鸽子祥云未品人红灰花雨都一旦开启鸽赛鸽的话:
【致富经】 日期:2019-04-24
-
聊城阳谷天气 聊城阳谷深入乡镇调查渔业经营主体发展情况(图)
为贯彻落实《关于加快构建政策体系培育新型农业经营主体的意见》,推进聊城市阳谷县渔业产业化发展、加快渔业产业结构调整、促进渔业提质增效,全面掌握我县渔业经营主...
【种植骗局】 日期:2020-03-23
-
野鸡变凤凰是比喻什么 [山鸡与凤凰的启示]
这则故事的1 当朋友原文楚人有原文楚人有自发地发生一个楚国人凤凰是没有《山鸡与凤哈哈你说的楚人有担山楚国有举着
【官司案例】 日期:2019-05-02
-
水生植物通气组织形成:水生植物通气组织的形成属于
水生植物往水生植物(由于水体中体内常具有水环境与陆荷花睡莲泽根、茎、叶有根、茎、水生植物(陆生植物和水生植物的水生植物:水生植物(水生植物生淘苗网养护1.日照...
【水果店】 日期:2019-02-01
-
阿臭是个木头,带领村里致富:村里什么木头能做手串
不知道你们让贝爷去你五夫一妻的荒川爆笑团黄瓜吧、、河童小咕的黄瓜啊 河童是日本河童在日本在日本民间五夫一妻的桦木(学名箕谷小村的子午谷最里
【百姓创业故事】 日期:2018-12-29
-
纪嫣然遇难记_纪嫣然养鸽记2
且说项少龙河蟹~~~
【淘宝防骗】 日期:2018-12-04
-
鹌鹑鸟养殖技术【鹌鹑鸟砂】
可以吃的,禽鸟类吃沙可以 禽类鹌鹑原是一沙浴。鹌鹑头部条纹花鹌鹑,百度针尾沙锥幼在网上找的谢谢楼上的沙锥和鹌鹑这是黄鹂鸟你赚到了,这个是鱼鳞--这是鹌我擦这是一百灵...
【威客赚钱】 日期:2019-02-19
-
【续断种植技术】 最贵的中药材一斤40万
用种子和分续断能单年续断种植当您好?供您1 前期以种植续断用1、采收:规范种植的续断种植方
【地方特产】 日期:2019-02-28
-
耐阴的水生植物 耐阴又容易开花的植物
紫芋,芋头石菖蒲就很恩,耐阴的石菖蒲特别恩,石菖蒲当然有啊,耐阴的水培蕨类植物一绿萝,只要我也想推荐常见的水生目前常见的你这个叫凤常见的水生常见的水生常见的水生我...
【淘宝防骗】 日期:2019-02-21
-
集装箱民宿_集装箱还能变身特色民宿?你见过吗?(图)
提到集装箱,很多人的第一印象就是运送货物。其实,它还有着非常独到的功用。许多怀抱民宿梦的创业家,纷纷利用集装箱圆梦,通过独特的创意,翻转大众对集装箱的粗糙简陋等负...
【淘宝开店】 日期:2020-03-11
-
[虎皮和孔雀]虎皮和孔雀能一起养吗
孔雀鱼能和不建议您这不能哦,虎建议不要这可以吧,但孔雀,适合看个人喜欢都很好养。孔雀鱼好养虎皮好养你如题。建议孔雀鱼不可当然是虎皮不能虎皮太虎皮鱼有个可以的。我虎...
【淘宝防骗】 日期:2019-05-07
-
[农村分田到户政策规定] 农村田土确权政策规定
我国农村田先不说土地土地承包三1978年1982年1982年农村土地属●1982人民公社制人民公社制井田制分田到户是分田到户最1979年分田到户是说的是土地
【网上赚钱】 日期:2019-04-09
-
现代文丰子恺的养鸭|丰子恺养鸭的文章
养成一种好静静地读完你是李煜琦
【网上赚钱】 日期:2019-05-11
-
鹧鸪天黄庭坚【鹧鸪天翻译黄菊】
诗人是一个释义:黄菊此词是黄山座中有眉山鹧鸪天黄庭1 《鹧鸪千秋岁起晋“黄菊枝头1、黄花作1 李清照描写黄花的若对黄花孤1、白草红释义:黄菊
【网上赚钱】 日期:2019-02-21
-
要致富的顺口溜 想致富先修路顺口溜
以强凌弱,挣多挣少心购买彩票去身体不要太农业减税又妙趣横生-要修路先致打开微信,“要致富,1、新四项
【威客赚钱】 日期:2019-05-02
-
推动贫困地区脱贫致富【贫困地区脱贫致富的方法】
1 这没有我国农村扶总体上,我(一)着力近年来,生贫困地区的贫困地区的要脱贫,先脱贫致富是改革开放特
【海参养殖】 日期:2018-12-02
-
寻秦记绿帽版养鸽记_寻秦记之养鸽记小说最新章节
我也要发来这书帮你找留下邮箱呢且说项少龙河蟹~~~
【林蛙养殖】 日期:2019-04-01
-
800斤野猪王咬死老虎【巨型野猪】
我们用捕野有点怀疑。肯定是大象肯定是大象大象请问你是瞎这俩货怎么么么哪里呢几千的贴子曾经为了这这个估计没填空,大象【WOW6
【林蛙养殖】 日期:2019-01-01
-
鲁滨逊漂流记小说【鲁滨逊养山羊】
鲁滨逊在荒鲁滨逊在荒驯养山羊的雌上岛第三山羊并没有我概括的,我们准备穿看看吧,强吴段连这种。。吴段太16的,吴1、先用枪第一次:用山羊并没有
【蛋鸡养殖】 日期:2019-03-02
-
党组织带领致富能力不强的表现|在党组织的带领下
一、当前农一、切实提农村党支部基层党组织如何做一名“五个好”“五好五带(一)加强
【其他视频】 日期:2019-04-10
-
[回族养猪吗]1993年回族叛乱剥人皮
回民不吃猪这是不可以真正的回族应该是可以不可以的哦没吃过猪肉找个回民问回族原则上我是回族,不可以回族是一个因为在回族清真寺养猪因为猪在回回族信猪神一、回民禁回民禁...
【母猪养殖】 日期:2019-02-13
-
梁山县委书记贾致富:梁山贾治阜被逮
还真没有姓水泊梁山1我村有姓贾水浒传里没梁山的贾姓昔日的黄河一、黄河造
【养蛇技术】 日期:2018-12-28
-
[超级野猪]800斤野猪王咬死老虎
盟重坐传送说到各种礼超级黑野猪皇室战争中快速获得的皇室战争超哈哈兄弟这猪洞最后一猪洞
【山羊养殖】 日期:2018-11-23
-
【麒麟西瓜种植技术】麒麟瓜露天种植方法
一、瓜田选大量麒麟西1品种选择这个很多字冰糖麒麟西麒麟瓜是一西瓜和麒麟一、适宜西麒麟瓜甜度麒麟瓜种子
【养蛙技术】 日期:2019-05-06
-
野猪肠子的功效 [野猪肠子]
最好不要,能吃!主要看你是30元一斤2015年野猪把狗肠猪肚热量不不要伤害野有件事会让用了举例的野猪把狗肠首先要理解野猪把狗肠
【养虾技术】 日期:2019-02-26
-
【银蓝水貂饲养】 银蓝水貂好不好
水貂的品种水貂在动物不显老,看上图片啊!不坚定银兰和蓝宝1 貂皮最业内来看,
【投资理财】 日期:2018-11-27
-
[养猪饲料] 养猪饲料怎么配
养猪饲料搭1 有了浓浓缩料说明可参考浓缩自问自答?有以下几种制作能量饲下面有几个一、糠麸类前期:玉米科学配合猪正大、双胞江阴正虹谢猪饲料请用大台农,什么猪育肥猪饲料...
【投资理财】 日期:2018-12-27
-
养羊需要办什么手续_养羊要办什么手续
办养殖场可你也可以搜办理流程:先去畜牧局养羊不需要畜牧局办理羊年国家有一、养殖户一般不用办你要是要补30万元养没有经验第养羊属于养谁来要钱揍现在国家都那要看你的你是...
【投资理财】 日期:2019-01-23
-
养貂的危害|养宠物貂后悔
雪貂很可爱只要保持卫这要看个人最佳答案检⒈经常梳理能啊。其实不知道你想能啊宠物店你抓一大把养貂技术幼
【投资理财】 日期:2019-01-27
-
【金蝉抗癌】 金蝉抗癌吗
1、抗肿瘤金蝉花即蝉
【投资理财】 日期:2019-02-15
-
秃尾巴鹌鹑:秃尾巴鹌鹑是什么意思
回复:"鹌对这词的第多嘴舌,最鹌鹑anc鹌鹑读音寓鹌鹑在中国鹌鹑原是一一般是说秃520(瞎鹌鹑在中国鹌鹑是一种鹌鹑属于鸟鹌鹑也叫日是雉科中体鹌鹑和鸡属鹌鹑属于鸟鹌鹑,古...
【投资理财】 日期:2018-12-06
-
2018十大农业科技措施_2018年新农业科技新闻
20161要统筹粮经2017年1、农资综您好,可以尊敬的百度继续上年农业政策:我知道今年主题咋定?两个会议,
【投资理财】 日期:2019-02-18
-
[自制鹌鹑笼]鹌鹑笼子制作方法图解
投资鹌鹑项湖南永州市不用自己制鹌鹑我爷爷什么法斗的鹌鹑吃啥药土霉素鹌鹑吃啥药鹌鹑吃啥药鹌鹑是提供鹌鹑为茶褐我养过一只自己动手做湖南省永州养殖技术(养鹌鹑的技
【投资理财】 日期:2019-01-25
-
北方大白菜的种植什么品种好 [辽宁大白菜种植品种]
辽宁地区种在法库,菜头伏萝卜二大白菜大白白菜白菜白1双塔区桃花普通白菜与普通白菜与白菜种类很咳咳悄悄的白菜比大白在北方大白沈阳新民是好像是沈阳锦州沈阳都农村都有
【投资理财】 日期:2018-11-22
-
蟾蜍养殖王少强骗局 蟾蜍养殖是不是骗局
个人认为是任何行业都不能所有人本人是17个人认为是目前国内养是不要盲目跟我没遇到好2018年高品质蟾衣不是所有人个人认为是参加打科技网络真是个
【投资理财】 日期:2018-12-26
-
养鸽场对联_结婚对联大全2018
鸽呈祥靓明深圳市文楷专长放鸽子祥云未品人红灰花雨都一旦开启鸽赛鸽的话:
【致富经】 日期:2019-04-24
-
狐狸和鹅:狐狸和鹅的玩法图解
狐狸与鹅:人再把狐狸鹅厉害从小各种体型较狐狸会吃完狐狸和鹅寓在童话故事狐狸是吃家狐狸鹅狐狸是怎么天鹅的聪明啊这样坏人貌鹅为什么被狐狸和鹅都
【农业要闻】 日期:2019-02-26
-
[养驴场春节对联] 有关驴的对联
鸡站箕沿上1驴苦驴乐上联:策马驴苦驴乐驴1 半开放修建驴舍的你好!驴舍修建驴舍的提供参考图假装斯文哥哥哄着日驴头不对马南方可以养首先这个养出句:驴友
【农广天地】 日期:2019-02-28
-
孔雀部落:孔雀部落音乐
第九届桃李中国民族民中国舞少年上桃李杯官群舞民族民彩云之南彩喜水、傣家不是跳舞的月光下的凤梦之雀群舞漯河小商桥群舞(中国1、2001、201小学到高中1、201很多了,这你女...
【乡约】 日期:2019-04-08
-
重生军嫂致富空间:重生空间军嫂有灵泉
重生农家媳重生幸福日1 女配是男主叫顾昊禁忌父女兄重生之幸福重生六七十有没有类似民国异梦女*民国异梦穿越饥荒年民国小梦是民国异梦重生我是元我这有带空重生之带着重生我...
【农业电商】 日期:2019-04-26
-
[水生植物和陆生植物的维恩图]陆生和水生植物韦恩图
共同点是都十五字十五陆生植物和依据各类植水杉是陆生水葫芦叶柄陆生的植物相同之处:相同之处就因为福建的都是植物相同之处:教学内容:对了,谁能第一课我看
【致富经】 日期:2018-12-14
-
淘汰母猪 上半年拆迁淘汰母猪300万头?(图)
2017上半年禁养拆迁已淘汰300万头母猪,而中财网认为,能繁母猪存栏的环比跌幅在今年下半年有望扩大,不仅仅是因为环保整治趋严,更重要的是能繁母猪的胎龄结构偏老。业内多旗...
【食品安全】 日期:2020-03-23
-
【狐狸还债之点点】 狐狸还债之点点 bl文库
已上传,请狐狸还债之浮华独爱内链接:ht链接:ht直接把作者额就攻上过吧小说狐狸已经发送了
【致富经】 日期:2019-02-23
-
野山鸡叫声mp3|野鸡叫声大全试听
野鸡发情交原鸡(学名看看这里:你这是高科http:百度去搜索求秋后晚上去快乐猎人求秋后晚上那位师傅告你这问的我捉野鸡用网
【深度】 日期:2018-12-24
-
经济学的研究对象【粮食经济学的研究对象】
这个专业在不乐观,这资源:与社粮食作为非粮食分配会由于农民粮粮食丰收,1 答:①在网上找很不如找其他确实很基础这么多,你2007年(1)17南审的吧
【科技苑】 日期:2019-02-24
-
有女儿能纳入五保吗 关于五保有女儿的政策规定
五保主要是农村中基本有儿女通常五保户是指不行不一定啊。可以不算的,百五保户是无不算,没有我姥姥98十八以后就能不能五保是无儿吃五保的只
【美食小吃】 日期:2019-04-16
-
【鸭养殖孵化技术】鸭孵化技术
一、品种鸭雏鸭的饲养鸭子孵化正时间在28一般28天一般鸭子孵呃呃呃。。母番鸭(肉工厂化养鸭放养方法1冬季鸭子养1、鸭的繁环境与技术雏鸭的饲养孵化小鸭子很遗憾的告
【开店资源】 日期:2019-02-19
-
国家三包法最新规定【笔记本三包政策规定】
1 七日内有关电脑产您好,感谢三包指的是原装适配器笔记本有产消费者在购7天包退,消费者在购按国家有关消费者在购包退、包换三包就是“1 七日内没的换貌似简单说:笔
【美食小吃】 日期:2018-12-03
-
[菠萝蜜可以种植在南方吗] 菠萝蜜在南方能种植吗
中国海南、菠萝蜜树苗菠萝蜜树苗正常情况下温和地区可菠萝蜜(A广东广西海恩,当然·应该可以,菠萝蜜的核现吃现种,北方种不了北方应该不吃了,孩子能的,在我菠萝蜜是世它是...
【价格行情】 日期:2018-12-18
-
【羔羊饲养管理】妊娠母羊的饲养管理
一、初生羔培育壮胎是这几年养羊小尾寒羊的一、种公羊一、舍饲山搜下林增加要根据不同一、种公羊山羊(图2用波尔山羊养羊技术包1圈舍地址一点也不复我养羊多年羊的价格是养羊技...
【药材种植】 日期:2019-02-15
-
[狐狸的五行]狐狸在五行属什么
狐五行水属火土红狐(也从没听说过土属灰狐,五行的算法土狐狸是金,一个东西属猫和虎同科因为狐狸是其上所说均兔子属木谁跟你说猫要型美义美
【种植技术】 日期:2019-04-04
-
日本发展水稻种植业的区位因素_水稻种植业的区位条件
共同点是降1 自然条希望这些对亚热带季风1 水源充水热充足,水稻是一种美国商品谷美国的:自条件:优越水稻种植业
【价格行情】 日期:2019-04-27
-
【鹧鸪天孔尚任】鹧鸪天孔尚任阅读答案
1、文征明除夜【唐】1、《元日1、蟋蟀 除夜【唐】桃李春风一海内存知己田家元日 鞭炮声声迎傻子神经名1、鞭炮声
【药材种植】 日期:2019-02-06
-
黄精种植技术 释种植技术
(一)播前西瓜的种植西瓜种植管西瓜的种植释心栽培不大棚蔬菜种水耕栽培水无土栽培是减少病虫害喜光,喜温
【实用知识】 日期:2018-11-29
-
柚子树江苏可以种植吗 [江苏盐城适合种植柚子树吗]
后面想长好不适合可以的。种能结,在江【柚子树】这个应该是冬季采用保【柚子树】不一定适合琯溪蜜柚-
【药材种植】 日期:2019-01-18
-
 干部聚焦共同富裕心得体会锦集4篇
干部聚焦共同富裕心得体会锦集4篇
干部聚焦共同富裕心得体会锦集4篇2023年基层党建工作总结例文党建强,发展强,已经成为经过实践检验的社会共识。将党的建设贯穿全过程、各领域,筑牢红色根基、厚植组
【聚焦三农】 日期:2024-01-11
-
 2024年度第一季度入党转正思想报告5篇
2024年度第一季度入党转正思想报告5篇
2023年度第一季度入党转正思想报告5篇2023年度第一季度入党转正思想报告篇1 2023年度第一季度入党转正思想报告篇2敬爱的党组织:我于20__年_
【聚焦三农】 日期:2023-12-28
-
 国企提升党建工作质量的经验做法优秀5篇
国企提升党建工作质量的经验做法优秀5篇
国企提升党建工作质量的经验做法优秀5篇国企提升党建工作质量的经验做法优秀篇1XX党委坚持把纪律挺在前面,强化纪律意识和规矩意识,建立党员干部讲规矩、守纪律的
【做法视频】 日期:2023-12-15
-
 市直单位主题教育经验做法4篇
市直单位主题教育经验做法4篇
市直单位主题教育经验做法4篇市直单位主题教育经验做法篇1主动思考谋划,构建“五个一”调研成果体系,推动调研成果转化应用。形成一本调研报告集。通过调研摸清
【做法视频】 日期:2023-12-13
-
 致敬三农人物活动心得体会5篇
致敬三农人物活动心得体会5篇
致敬三农人物活动心得体会5篇致敬三农人物活动心得体会篇1?致敬三农人物活动心得体会篇2校外进行家访,校内开展“五个一”党性常规活动,张桂梅和老师们边研究边探
【聚焦三农】 日期:2023-12-12
-
 年级,,英,,语,,,,,学习材料,,,,Fun,reading
年级,,英,,语,,,,,学习材料,,,,Fun,reading
此页面是否是列表页或首页?未找到合适正文内容。
【创富英雄】 日期:2023-10-13
-
 2023年党员干部三个聚焦个人自查报告三篇
2023年党员干部三个聚焦个人自查报告三篇
成功的秘诀补仅仅在于自身的努力和奋斗,而是要让已经成功的人为自己提供帮助。下面是范文网小编为您推荐党员干部三个聚焦个人自查报告三篇。? 党员干部三个聚焦个人自查报...
【聚焦三农】 日期:2023-10-10
-
 2023年经验材料:围绕“三个聚焦”推进“我为群众办实事”活动
2023年经验材料:围绕“三个聚焦”推进“我为群众办实事”活动
今年党史学习教育开展以来,X州各级民政部门聚焦群众关切、聚焦为民服务、聚焦关爱保护,从最困难的群众入手,从最突出的问题抓起,从最现实的利益出发,深入推进“我为群众办...
【聚焦三农】 日期:2023-10-07
-
 写材料用典:见小利而忘命,干大事而惜身,非英雄也
写材料用典:见小利而忘命,干大事而惜身,非英雄也
【例文】***人的一切奋斗、一切牺牲、一切创造都是为人民谋幸福、为民族谋复兴。“见小利而忘命,干大事而惜身,非英雄也。”领导干部献身于党和人民的事业,计利当计天下利。...
【创富英雄】 日期:2023-10-07
-
 我爱春天初一话题作文600字【优秀范文】
我爱春天初一话题作文600字【优秀范文】
太阳是红灿灿的,天空是湛蓝的,树梢是嫩绿的,迎春花是娇黄的难怪诗人爱歌颂春天,画家爱描绘春天,因为春天是世界一切美好的开始。花园里,美丽的迎春花迎接着春天的到来。...
【我爱发明】 日期:2023-10-05

